Для домашнего употребления водный раствор очищается более тщательно, чем для технических применений. Исключениями являются такие области, как электронная и фармацевтическая промышленности, где необходима дистиллированная вода.
Жесткая и мягкая вода — что это значит. Виды жесткости воды
Часто клиенты обращаются к нам, как к специалистам, чтобы узнать подробнее о том, что такое жесткая и мягкая вода, их особенности и существующие методы смягчения. Мы подготовили несколько статей на эту тему, и надеемся, что они помогут ответить на большинство ваших вопросов относительно жесткости воды.
Если говорить простым языком, то жесткая вода — это H2O, содержащая большое количество растворенных в ней солей щелочноземельных металлов, главным образом кальция и магния (более точно, это катионы Са и Mg). Напротив, мягкая вода содержит минимальное их количество. Для измерения количества так называемых солей жесткости в воде используется единица миллиграмм-эквивалент на литр — мг-экв./л. Один мг-экв./л показывает, что в одном литре воды имеется 20,04 мг катионов Са или 12,16 мг катионов Mg (подсчитано на основе атомной массы, деленной на валентность).
Существует несколько классификаций жесткости воды. В Российской Федерации вода считается жесткой, если в ней содержится более 10 мг-экв./л солей. Вода со содержанием солей от 2 до 10 мг-экв./л квалифицируется как средне жесткая, а вода с концентрацией солей ниже 2 мг-экв./л — как мягкая.
Интересный факт: дождевая вода относится к мягким видам, так как перед тем, как выпасть в виде дождя, она проходит стадию испарения. В процессе парообразования соли жесткости не испаряются и, следовательно, фильтруются естественным образом. Жесткость воды возрастает, когда она проходит через почву, собирая соли, содержащиеся в ней.
 |
 |
| Государственный стандартный образец (ГСО) Общая жесткость воды |
Набор для измерения жесткости воды |
Откуда взялись названия жесткая и мягкая
С давних времен люди замечали, что после стирки одеяльных принадлежностей в одной воде, они остаются мягкими на ощупь, тогда как после стирки в другой воде становятся грубыми и жесткими. Соответственно, воду, которая делает вещи мягче, люди стали называть мягкой, а воду, которая делает их жесткими, — жесткой.
Кроме того, в некоторых кругах существует мнение, что мягкая вода считается «живой», а жесткая — «мертвой». Это заблуждение. Конечно, в научных кругах существуют теории, которые пока не нашли официального подтверждения, но и не были опровергнуты. Согласно этим представлениям, вода с щелочной реакцией обладает определенными полезными свойствами и носит название живой. В противоположность этому, кислотная вода считается мертвой. Однако между этими терминами и концепцией жесткости воды имеется лишь слабая связь.
Что такое жесткость воды (определение)
- Временная (карбонатная). При интенсивном нагревании под действием времени из-за высокой температуры в воде образуется белесый осадок кальция (накипь), который оседает на дне и стенках посуды. Соли кальция и магния карбонатной жесткости также накапливаются на теплообменниках, что затрудняет теплообмен и может привести к повреждениям трубопроводов и другого гидротехнического оборудования.
- Постоянная (некарбонатная). Соответствует тем солям, которые не распадаются при кипячении, для удаления которых применяются специальные фильтры умягчения.
- Общая жесткость питьевой воды. Это общ — общий показатель концентрации как кальция, так и магния в воде.
При базовом анализе воды определяется общая жесткость (Жобщ), а более углубленное исследование позволяет вычислить содержание кальция, магния и других элементов в образце.
В чем измеряется жесткость воды
Существуют как системные, так и внесистемные международные единицы измерения:
- миллиграмм-эквивалент на один литр (на 1 дм³) — мг-экв/л;
- моль на один кубометр — моль/м³;
- градус жесткости — °Ж;
- миллимоль на 1 литр — ммоль/л (вместо устаревшего обозначения °dH);
- parts per million (ppm, одна миллионная части величины 10⁻⁶, т.е. 1 мг солей в 1 литре) — ppm или мг/л.
В Российской Федерации наиболее часто используются единицы измерения: мг-экв/л и °Ж (ГОСТ 31865-2012). Примечательно, что 1 мг-экв/л соответствует 1°Ж, 1/2 ммоль и 50.05 ppm. Это составляет содержание 20 мг Ca²⁺ и 12 мг Mg²⁺ в одном литре водного раствора.
Единицы измерения
Концентрация солей определяется в миллиграмм-эквивалентах на литр: 1 мг-экв/л соответствует 20,04 мг Са²⁺ и 12,16 мг Мg²⁺. В международной системе СИ этот показатель выражается в молях на кубический метр (моль/м³). В нашей стране для обозначения жесткости удобно использовать градусы жесткости, где 1 °Ж = 1 мг-экв/л или 0,5 ммоль/л.
Градусы жесткости используются и в других странах, но их числовые значения могут различаться:
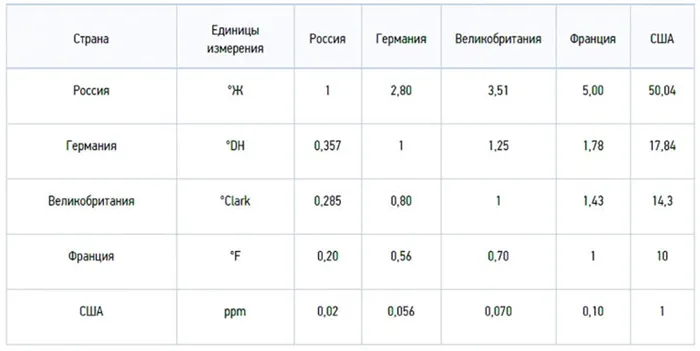
- немецкий градус жесткости 1ºdH = 10 мг/л СаО или 7,194 мг/л MgO;
- французский градус 1ºfH = 10 мг/л СаСО₃;
- английский 1 ºClark = 14,254 мг/л СаСО₃;
- американский 1 gpg = 17,12 мг/л СаСО₃.
Для реализации перехода между разными единицами измерения удобно использовать еще одну американскую единицу – PPM (ППМ), которая равна 1 мг/л СаСО₃. Из этого следует, что:
- 1ºdH = 17,9 ppm;
- 1ºfH = 10,0 ppm;
- 1 ºClark = 14,25 ppm;
- 1º gpg = 17,1 ppm;
- 1ºЖ = 50,05 ppm.
Осуществить переход ррm в удобные градусы жесткости ºЖ можно с помощью конвертера. Для смены между градусами можно воспользоваться следующей шкалой:
1 ºЖ = 2,804 ºdH = 3,5 ºClark = 5,005 ºfH = 2,924 gpg = 50,05 ppm.
Нормы жесткости
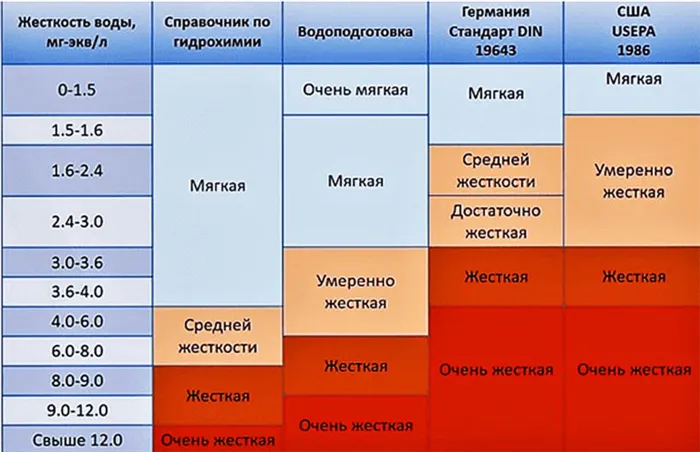
По параметру общей жесткости вода классифицируется следующим образом:
- мягкая — до 4 ºЖ;
- средней жесткости — от 4 до 8 ºЖ;
- жесткая — более 8 ºЖ.
Разнообразие природных условий в России затрудняет установление единой нормы жесткости для всех регионов. Предельно допустимая концентрация (ПДК) Са²⁺ варьируется в широких пределах в зависимости от местных условий.
Тем не менее, стандарты для питьевой воды не отличаются от установленных Всемирной организацией здравоохранения (ВОЗ). С 01.01.2014 в нашей стране действует национальный стандарт ГОСТ 31954-2012, который учитывает основные международные нормативы по качеству воды и методам ее анализа. Этот стандарт применим для всех подземных и поверхностных источников.
Таблица 1. Нормативные значения концентраций кальция и магния в питьевой воде
| № | Норм. документ | Продукт | Са, мг/л | Mg, мг/л | Градусы, ºЖ |
|---|---|---|---|---|---|
| 1 | СанПин_2.1.4.1074-01, ГН_2.1.5.1315-03 |
Питьевая вода | Не регламентируется | Не регламентируется | 7 |
| 2 | СанПин 2.1.4.1116-02 | Бутилированная вода | 25-130 | 5 — 65 | 1,5-7 |
| 3 | Нормы ВОЗ | Питьевая вода | 20-80 | 10 — 30 | Не предлагается |
Состав воды в зависимости от ее назначения регулируется шкалой жесткости:
- допустимый показатель для водопроводной воды — 300 ppm или 6 ºЖ;
- оптимальное значение для природных водоемов — в пределах 400 ppm или 8 ºЖ;
- предельно допустимый уровень жесткости — 500 ppm или 10 ºЖ;
- концентрация солей, представляющая опасность для здоровья — более 500 ppm, что соответствует > 10 ºЖ.
Особо строгие требования касаются воды, используемой в нагревательных котлах на электростанциях — общий показатель жесткости не должен превышать 0,05–0,1 мг-экв/л.
Эффект жесткой воды
Жесткость воды — это показатель концентрации растворенных в ней солей магния (Mg) и кальция (Ca), таких как гидрокарбонаты, хлориды и сульфаты. Попросту говоря, жесткой называется вода, содержащая в себе высокое количество солей. Наименование «жесткая» связано с историей: женщины в старину стирали свои вещи на берегах рек и озер, где вода была насыщена кальцием, что делало ткань на ощупь жесткой.
Жесткость воды подразделяется на три категории:
- Карбонатная, или временная. Этот тип жесткости можно устранить с помощью обычного кипячения, так как он обусловлен наличием гидрокарбонатов кальция и магния Са(НСО₃)₂ и Mg(НСО₃)₂.
- Некарбонатная, или постоянная. Возникает благодаря наличию других солей, например CaSO₄, Ca(Cl)₂, MgSO₄, Mg(Cl)₂. Она не устраняется при кипячении.
- Общая жесткость. Отражает суммарную концентрацию ионов кальция и магния, то есть является суммой карбонатной и некарбонатной жесткости.
Единицы измерения жесткости:
На сегодняшний день не существует единой единицы измерения жесткости. В России, согласно Госстандарту, для количественной оценки жесткости воды используется моль на кубический метр (моль/м³). В Германии и некоторых других государствах применяется 2.8 DH°; во Франции — 5 F°; в Соединенных Штатах Америки — 50.05 ppm CaCO₃.
Классификация воды по жесткости:
| Характеристика | Жесткость, мг-экв/л |
| очень мягкая вода | до 1,5 мг-экв/л |
| мягкая вода | от 1,5 до 4 мг-экв/л |
| вода средней жесткости | от 4 до 8 мг-экв/л |
| жесткая вода | от 8 до 12 мг-экв/л |
| очень жесткая вода | более 12 мг-экв/л |
Согласно требованиям СанПиН 2.1.4.1074-01, жесткость питьевой воды не должна превышать 7 мг-экв/л.
Влияние на здоровье человека:
Каким образом жесткая вода воздействует на организм человека? Существуют мнения, что жесткая вода может быть связана с возникновением мочекаменной болезни. Однако на сегодняшний день нет официального подтверждения задействования этой гипотезы. Известно, что чрезмерно жесткая вода негативно сказывается на органолептических свойствах, придавая ей привкус, который может определяться как горьковатый. Также такая вода высушивает кожу и волосы. Тем не менее, не рекомендуется полностью переходить на мягкую воду, поскольку наш организм нуждается в солях кальция и магния, которые укрепляют сердечно-сосудистую систему. А вот комнатные растения лучше всего поливать мягкой или талой водой.
Для смягчения жесткости воды специалисты рекомендуют использовать умягчители, которые являются самыми эффективными в борьбе с минеральными солями. Существуют способы смягчения воды в домашних условиях, самым простым из которых является кипячение.
К борьбе с постоянной жесткостью воды также причисляется метод вымораживания. Достаточно заморозить воду и, когда примерно 90% жидкости превратится в лед, разморозить. Соли останутся в оставшейся жидкости, не подверженной замерзанию.
При выборе оптимальной жесткости воды рекомендуется придерживаться средней жесткости. Наилучшим вариантом будет использование воды средней жесткости для приготовления пищи и мягкой воды для гигиенических процедур. Чтобы избежать негативного воздействия повышенной жесткости на бытовую технику, стоит рассмотреть возможность приобретения умягчителя.
Если вы желаете заказать анализ воды на жесткость, вы можете сделать это на нашем сайте vodalab.ru. Все представленные на сайте анализы включают исследование воды на жесткость.
О других загрязнителях воды, таких как железо, мутность и марганец, также можно узнать подробнее на нашем блоге.
Методы устранения жесткости воды
Для снижения концентрации примесей в растворе применяются различные методы.
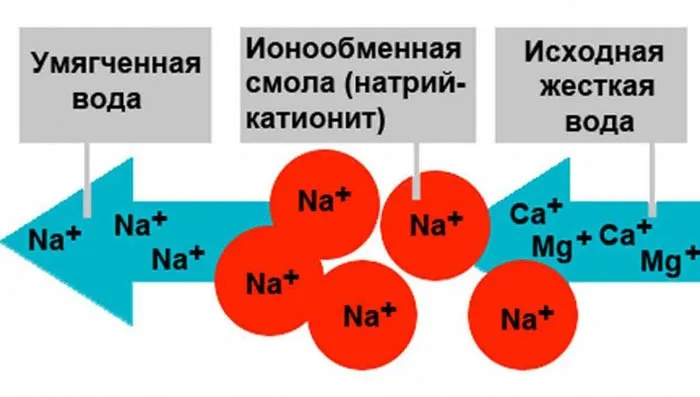
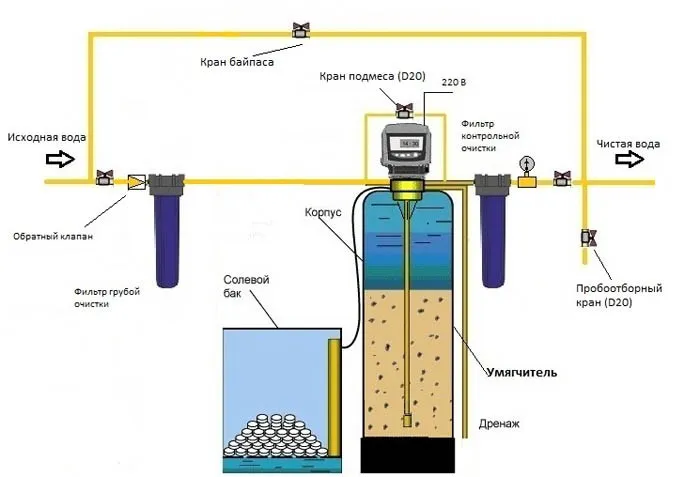
Катионирование
Ионообмен — это процесс, направленный на снижение концентрации вредных соединений. Суть метода заключается в замене катионов кальция и магния в растворе на катионы натрия или водорода. Когда жесткая вода проходит через катионит, происходит обменный процесс, при котором образуются нерастворимые соединения Ca²⁺ и Mg²⁺, которые фиксируются в субстрате. В раствор переходят катионы Na⁺ или H⁺, которые не образуют накипи.
Для улучшения эффективности очистки часто ионообмен комбинируют с другими методами или выполняется в несколько этапов, при каждом из которых регулируется концентрация катионита.
Термоумягчение
Термоумягчение — это наиболее простой способ, применяемый в домашних условиях, и подходит лишь для карбонатной жесткости. При кипячении карбонатные соединения разлагаются, что делает воду пригодной для питья.
Недостатком термоумягчения является то, что этот метод эффективен только для удаления карбонатных соединений.

Реагентное умягчение
Для реагентного умягчения в раствор добавляют кальцинированную соду, гашеную известь или ортофосфат натрия. Соли кальция и магния взаимодействуют с этими веществами, образуя твердые компоненты, которые затем можно отфильтровать. Этот способ часто используется в промышленности.
Недостатком реагентного умягчения является быстрое изнашивание фильтров, которые необходимо заменять каждые 5-7 лет.
Обратный осмос
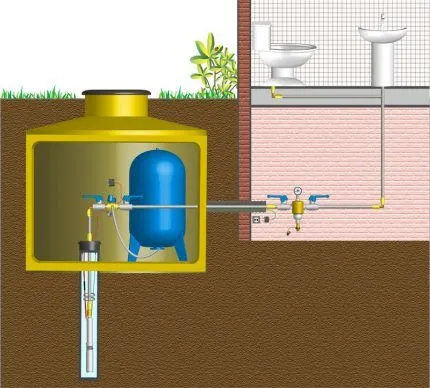
Этот метод позволяет очищать воду от 99% всех примесей. Вода проходит через полупроницаемую мембрану под значительным давлением. Обратный осмос применяется в домашних очистителях, таких как фильтры под мойку, которые можно приобрести в Тюмени в интернет-магазине КВАНТА+. В производстве используются мембраны различного размера, которые позволяют очищать воду от 40% примесей.

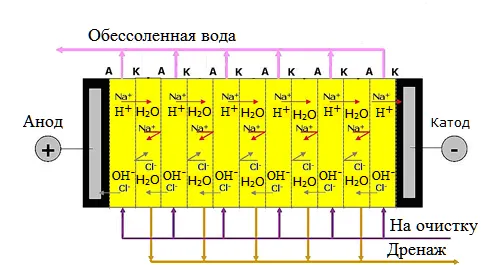
Электродиализ
В этом методе водный раствор помещается в контейнер, разделённый множеством перегородок с мембранами. Вода в этом состоянии не проводит электрический ток. При пропускании тока через раствор ионы притягиваются к противоположно заряженным мембранам и оседают на них. Это позволяет снизить концентрацию вредных соединений. Метод позволяет очищать воду без использования реагентов.
Однако электродиализ имеет свои недостатки, например, накопление солей на мембранах, из-за чего детали установки требуют частой замены. Кроме того, необходима предварительная очистка воды от коллоидных соединений.
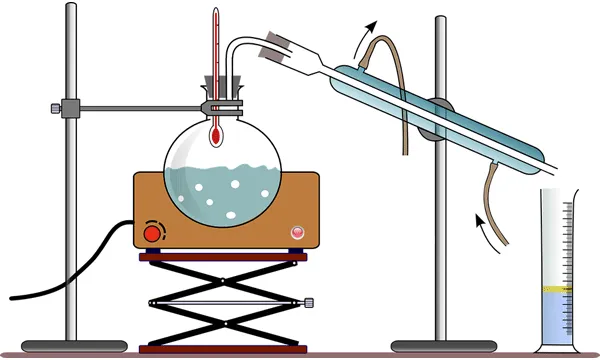
Дистилляция
Дистилляция применяется гораздо реже для смягчения воды. Она предполагает нагрев воды до 100°С. При этом более легкие соединения испаряются, в то время как соли остаются в установке после выпаривания жидкости. Полученный пар охлаждают, и в результате получается вода, смягченная таким образом, которая содержит примеси, безопасные для человека.
Дополнительная информация
Интересные факты об очистке воды:
- Во многих странах существовала традиция бросать серебряные монеты в колодцы. Серебро может реагировать с некоторыми солями, однако не со всеми. Основная причина отказа от этого метода заключается в токсичности. По нормам СанПиН серебру присвоен 2-й класс вредности, но оно опасно только при накоплении в организме.
- Неочищенная вода была причиной множества эпидемий тифа, холеры и других заболеваний, а также низкой продолжительности жизни, вызванной повышенным содержанием вредных соединений. Человечество стремилось создать очистные сооружения начиная с древности. Например, в Египте впервые были разработаны методы фильтрации воды.
- Существует миф о том, что повторное кипячение воды приводит к образованию вредных веществ, хотя это не соответствует действительности. Химический состав раствора при повторном нагреве не изменяется.
- Многие считают, что бутилированная вода гораздо чистее, чем фильтрованная, однако уровень содержания примесей в них схож.
Выбрать подходящую систему очистки можно, обратившись к специалистам из КВАНТА +. Фильтры способны задерживать не все вредные соединения, поэтому перед покупкой следует ознакомиться с теми солями, которые содержатся в вашей воде.